研究背景
受体相互作用蛋白激酶1(RIPK1)在脑缺血再灌注(I/R)损伤的坏死和凋亡调控中起着重要作用,但其激酶活性在缺血性脑卒中中的调节机制尚不清楚。山东大学基础医学院刘慧青教授、高成江教授、陈琳副教授团队在Acta Pharmaceutica Sinica B (IF 14.6)上发表文章“The protein arginine methyltransferase PRMT1 ameliorates cerebral ischemia–reperfusion injury by suppressing RIPK1mediated necroptosis and apoptosis”,发现PRMT1通过抑制RIPK1激活来阻断坏死和凋亡,从而防止I/R损伤,并表明PRMT1将成为治疗缺血性卒中的潜在靶点。
· 维真助力 - AAV ·
实验动物
8-10周龄雄性野生型C57BL/6小鼠
病毒产品
AAV9-hSyn-PRMT1、
AAV9-EV
注射方式
立体定位注射-左侧皮质
病毒用量
2 μL(1.0×1013 vg/mL)
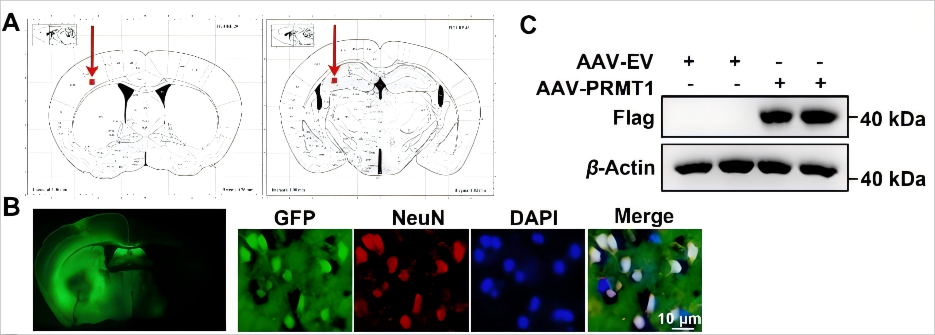
AAV9载体有效介导小鼠脑区PRMT1的过表达
结果展示
1. PRMT1通过促进RIPK1 R658甲基化抑制RIPK1自磷酸化
作者发现脑I/R损伤后PRMT1蛋白水平下调,并与p-RIPK1呈负相关。在OGD/R处理的PC12细胞中,PRMT1的药物抑制和基因敲除增强了坏死和凋亡,但PRMT1过表达抑制RIPK1介导的坏死和凋亡,并发现PRMT1通过抑制RIPK1的激活,减轻了OGD/R诱导的PC12细胞坏死和凋亡。机制研究发现PRMT1与RIPK1直接相互作用,通过促进RIPK1 R658甲基化抑制RIPK1自磷酸化,表明PRMT1通过催化R658处的RIPK1精氨酸甲基化发挥其神经保护作用。
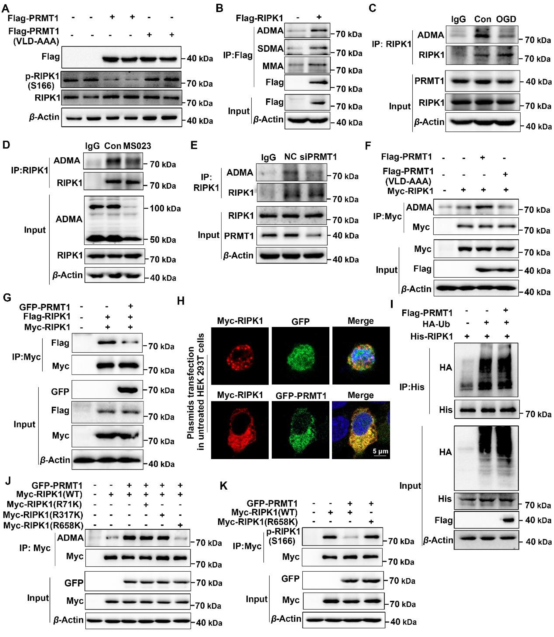
图1. PRMT1通过促进RIPK1的甲基化来抑制其自身磷酸化
2. PRMT1的药物抑制或基因消融加重了MCAO/R小鼠的脑损伤
为了进一步研究PRMT1在体内脑I/R损伤中的潜在作用,作者在MCAO/R前30分钟将MS023(PRMT1的抑制剂)注射至小鼠脑室内。发现MS023处理明显增加了MCAO/R诱导的神经功能缺损评分和梗死体积,加重了海马和皮质神经元形态损伤,增加了TUNEL阳性细胞数量。此外MS023进一步增加了I/R脑组织中p-RIPK1(S166)、p-MLKL(S345)和活化型Caspase-3蛋白水平,以及IL-1β、IL-6和TNF-α等促炎细胞因子的mRNA水平。作者还构建了Prmt1神经元条件性敲除小鼠(Prmt1 CKO),然后对Prmt1 CKO小鼠和WT对照进行了2小时MCAO和24小时再灌注。同样发现PRMT1缺乏会增加神经功能缺损评分、梗死体积和TUNEL阳性细胞比例,提高p-RIPK1(S166)、p-MLKL(S345)和活化型Caspase-3蛋白水平。这些数据表明Prmt1的药物抑制或基因敲除加剧了脑I/R损伤。
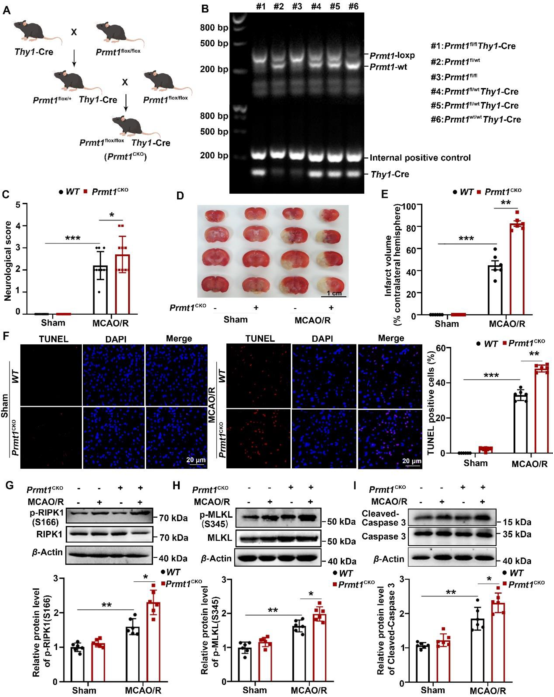
图2. PRMT1缺乏加剧了脑I/R损伤
3.PRMT1过表达可减轻MCAO/R所致的脑损伤
基于神经元中PRMT1的明显下调,作者通过将AAV-PRMT1注射至小鼠脑中过表达PRMT1,并通过脑切片中的GFP荧光和皮质组织的蛋白质印迹分析评估了PRMT1过表达的效率。实验结果显示PRMT1过表达显著减轻了MCAO/R小鼠的脑I/R损伤。此外在MCAO/R后,PRMT1过表达小鼠中TUNEL阳性细胞的比例低于对照小鼠。同时PRMT1过表达抑制了I/R脑组织中RIPK1及其下游信号p-MLKL的激活(S345)和活化型Caspase-3蛋白水平,降低了MCAO/R后缺血脑组织中促炎细胞因子的mRNA水平。
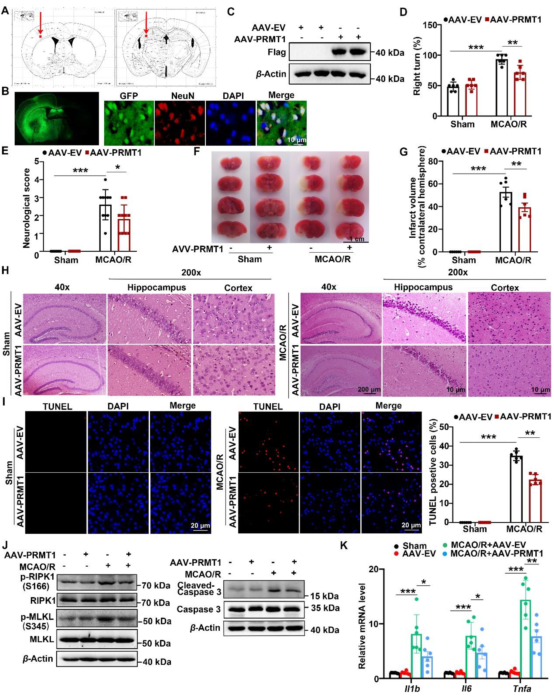
图3. AAV-PRMT1改善MCAO/R所致的脑损伤
实验结论
本研究发现PRMT1是脑I/R损伤后RIPK1依赖性凋亡和坏死的调节因子,在机制上PRMT1直接靶向RIPK1并介导其修饰,抑制RIPK1的二聚化和磷酸化,从而减轻RIPK1依赖性凋亡和坏死。脑I/R损伤引发PRMT1的下调,促进RIPK1的激活,加重脑损伤。鉴于PRMT1在脑I/R损伤中的关键作用,PRMT1将成为治疗中风的潜在治疗靶点。
