针对目标蛋白抗体把蛋白-RNA复合物沉淀下来,并对复合物上的RNA进行测序或对目标RNA进行qRCR表达分析。
4.2 RNA pull-down+MS/WB/qPCR/RNA-Seq
设计目标RNA生物探针把相应的结合蛋白质与RNA复合物沉淀下来,蛋白质谱检测或WB检测与RNA结合的蛋白。设计目标RNA生物探针把相应的结合蛋白质与RNA复合物沉淀下来,qPCR检测或RNA-seq检测与RNA结合的RNA。
4.3双荧光素酶报告实验
双荧光素酶报告实验检测两个基因之间的互作。
4.4病 毒液以及siRNA设计
提供circRNA过表达以及干扰慢病 毒,腺病毒以及设计siRNA。
云序微量样本文章列表
云序生物作为以高通量测序技术为依托的科研服务公司,拥有丰富的微量样本测序经验,为众多临床与基础科研研究者提供了高质量的科研服务,助力客户发表过众多外泌体的SCI文章。

, 文章导读
外泌体是细胞分泌的大小为30-200nm的盘状囊泡,它在人体体液中分布广 泛。2013年,科学家通过研究外泌体细胞囊泡调控机制获得诺贝尔奖,这使外泌体开始被广 泛关注,随着研究的深入,人们发现外泌体可作为细胞间信息交流的桥梁,在细胞间往来穿梭进行信息传递。另外,外泌体与疾病的发生尤其是在肿 瘤中起到十分关键的作用,因此,外泌体也成为了研究疾病以及靶向治 疗的切入点。
尽管外泌体的研究十分火热,但前期研究主要集中在外泌体的信息传递以及外泌体中microRNA的作用机制等方面,关于外泌体中环状RNA的研究仍方兴未艾,今 天小编就近日新发表的三篇外泌体环状RNA高 分文章进行解析,希望能够使大家对外泌体中的环状RNA的研究有一些新的认识。
文章展示
1.肝ai细胞来源的外泌体circUHRF诱导自然杀伤细胞的衰竭,影响抗PD1治 疗的耐药性
发表期刊:Molecular Cancer
影响因子:15.302
发表时间:2020.6.27
文章链接:Cancer cell-derived exosomal circUHRF1 induces natural killer cell exhaustion and may cause resistance to anti-PD1 therapy in hepatocellular carcinoma
2020年6月27日,Molecular Cancer(IF=15.302)杂志上发表了一篇题为“Cancer cell-derived exosomal circUHRF1 induces natural killer cell exhaustion and may cause resistance to anti-PD1 therapy in hepatocellular carcinoma”的文章,文中对肝ai(HCC)细胞分泌的外泌体中circUHRF1的研究发现,circUHRF1可以通过与miR-449c-5p形成海绵机制从而影响其下游基因TIM-3的表达,抑 制自然杀伤细胞(NK)功能并提高了抗PD1免疫疗法的耐药性。
(1)circUHRF1在肝ai组织中表达上调
通过环状RNA测序数据分析得到UHRF1在肝ai组织中表达上调,并在其病理过程中起重要作用。后通过qPCR技术检测HCC中的标志基因UHRF1来源的14个circRNA,发现hsa_cic_0048677(circUHRF1)是肝ai组织中表达量高的环状RNA。并且在HCC组织中circUHRF1的表达高于非肿 瘤组织。临床生理表型显示circUHRF1表达高的患者中肿 瘤体积较大,血液中NK细胞比例较低,微血管浸润较多。Kaplan-Meier生存分析显示,circUHRF1高表达患者伴随临床预后不良。综上所述,HCC细胞中circUHRF1表达上调与患者预后不良相关,并表明circUHRF1表达上调可能参与了HCC的进展。
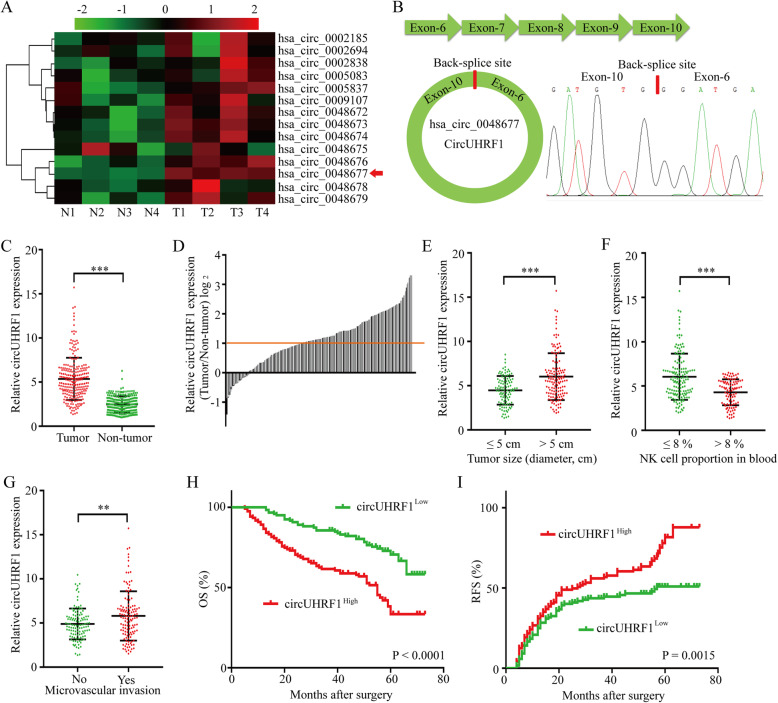
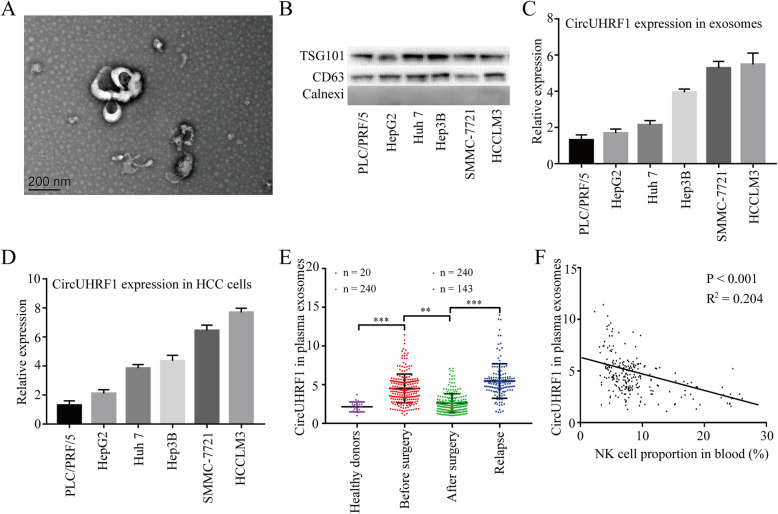
作者从六种肝ai细胞系中分离并利用电镜(TEM)和WB鉴定了相应的外泌体。qPCR显示HCCLM3和SMMC-7721细胞系衍生的外泌体circUHRF1的表达高。为了研究circUHRF1是否可以由HCC细胞通过外泌体递送到HCC患者血浆中。进行了qPCR鉴定了血浆外泌体circUHRF1,结果显示HCC患者血浆外泌体circUHRF1水平较高,肿 瘤切除后血浆外泌体circUHRF1水平降低,肿 瘤复发患者血浆外泌体circUHRF1水平升高,说明血浆外泌体circUHRF1主要由HCC细胞产生。此外,外泌体circUHRF1水平的升高常伴随着NK细胞比例降低。上述数据表明,外泌体circUHRF1可能是决定NK细胞相关免疫逃避的关键分子。
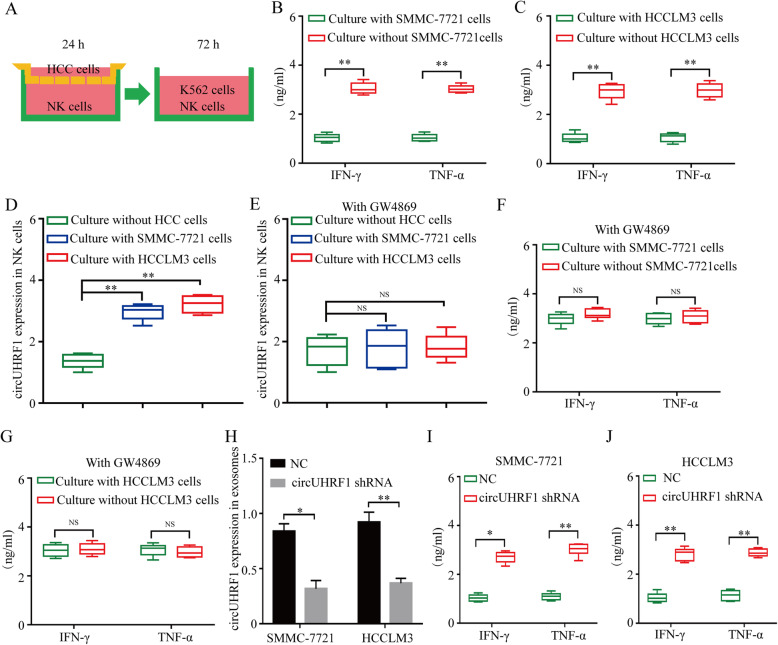
为确定HCC细胞衍生的外泌体circUHRF1是否可以诱导NK细胞功能异常,作者将NK细胞与HCCLM3和SMMC-7721细胞进行共培养。结果表明,与SMMC-7721和HCCLM3细胞共培养的NK细胞中分泌IFN-γ和TNF-α受到抑 制且circUHRF1表达的明显增强,但这两种作用可以被外泌体抑 制剂GW4869所阻断。为进一步研究HCC细胞是通过外泌体circUHRF1介导NK细胞功能障碍,作者利用shRNA敲低了SMMC-7721和HCCLM3 细胞中circUHRF1的表达,qPCR显示在敲低circUHRF1的肝ai细胞中,外泌体circUHRF1的表达明显降低,从而改善NK细胞中IFN-γ和TNF-α的分泌受损。这些结果说明,HCC通过外泌体circUHRF1抑 制NK细胞功能。
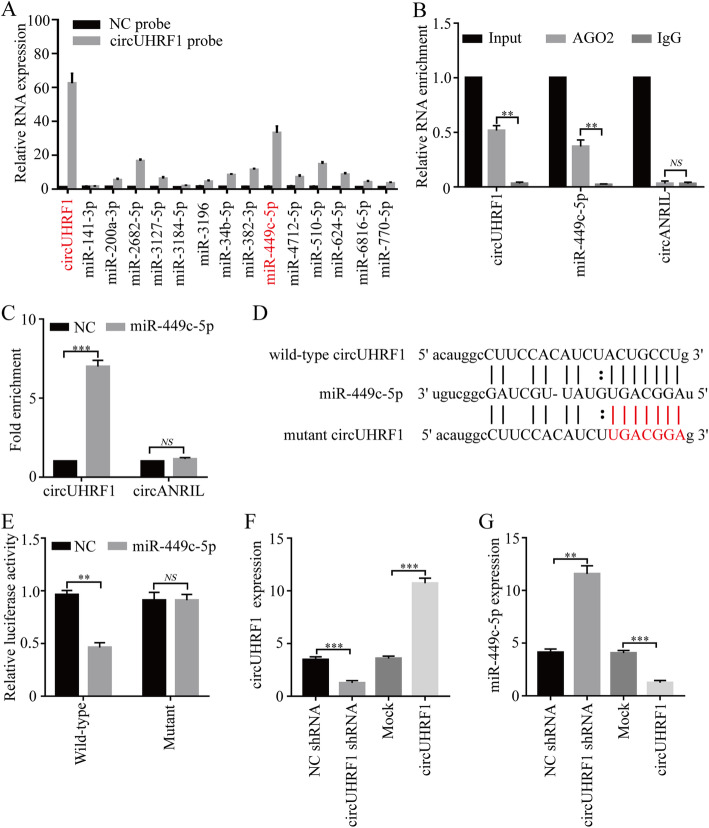
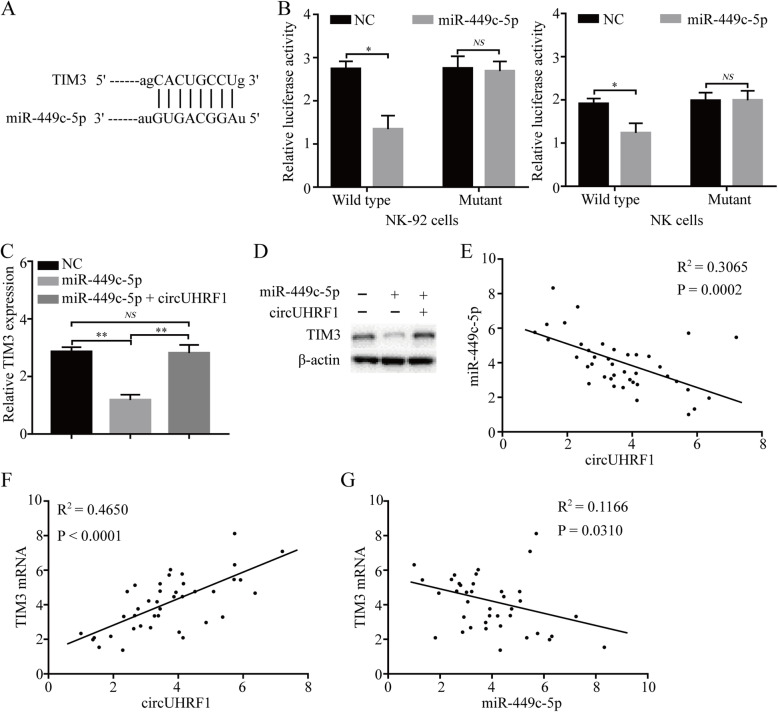
作者利用生物信息学预测了14个miRNA,在NK-92细胞中进行circUHRF1-RIP以及qPCR,结果表明miR-449c-5p是NK-92细胞中一个与circUHRF1相互作用的miRNA。在NK-92细胞中进行抗AGO2抗体的RIP和生物素化miR-449c-5p的RNA pull-down实验,证明了circUHRF1可以直接与miR-449c-5p结合。此外经双荧光素酶报告实验和分别在NK-92细胞中过表达circUHRF1和miR-449c-5p,证明了在NK细胞中circUHRF1和miR-449c-5p可能相互靶向。此外单独过表达miR-449c-5p会明显抑 制肿 瘤的活性,但增加circUHRF1表达明显抑 制miR-449c-5p的肿 瘤抑 制功能,说明HCC衍生的外泌体circUHRF1通过miR -449c-5p相关途径抑 制NK细胞功能。
作者分析了NK细胞中预测的miR-449c-5p靶基因TIM-3,同样进行了双荧光素酶报告实验,结果显示miR-449c-5p能直接与靶基因TIM-3的3’UTR区直接结合。超表达miR-449c-5p后TIM-3表达明显降低。为了验证NK细胞中外泌体circUHRF1的持续上调吸附miR-449c-5p,从而导致TIM-3的表达上调造成HCC的免疫逃避这一观点。作者检测了miR-449c-5p单独或与circUHRF1共同转染的NK-92细胞中TIM-3的表达。结果显示,miR-449c-5p超表达导致TIM-3 mRNA和蛋白表达水平下降,而circUHRF1逆转了miR-449c-5p的抑 制作用。在体内同样证实了circUHRF1通过调控miR-449c-5p/TIM-3轴来阻碍NK细胞的功能。
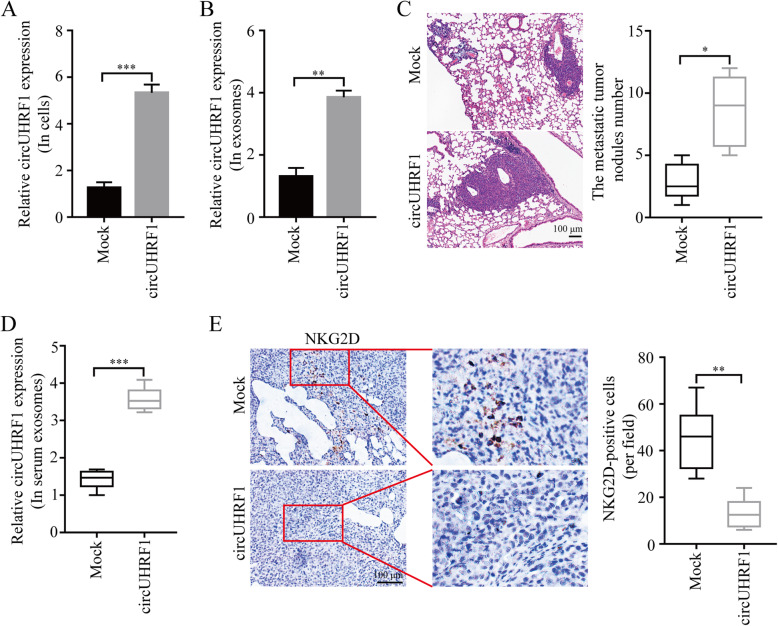
为了进一步探讨circUHRF1在HCC中的作用,使用pLO5-ciR-circUHRF1上调了PLC / PRF / 5细胞中circUHRF1的表达。qPCR结果显示,在过表达circUHRF1的HCC细胞中,外泌体circUHRF1水平也明显上调。此外,使用PLC/PRF/5细胞构建肺转移的NOD/SCID小鼠模型(注射来自健康供者的NK细胞)。结果表明,在接种过表达circUHRF1细胞的肺转移小鼠内,血浆外泌体中circUHRF1水平更高,肺部的转移瘤结节更多及结节内NKG2D阳性细胞更少。说明,circUHRF1以外泌体和NK细胞依赖性的方式促进HCC进展。
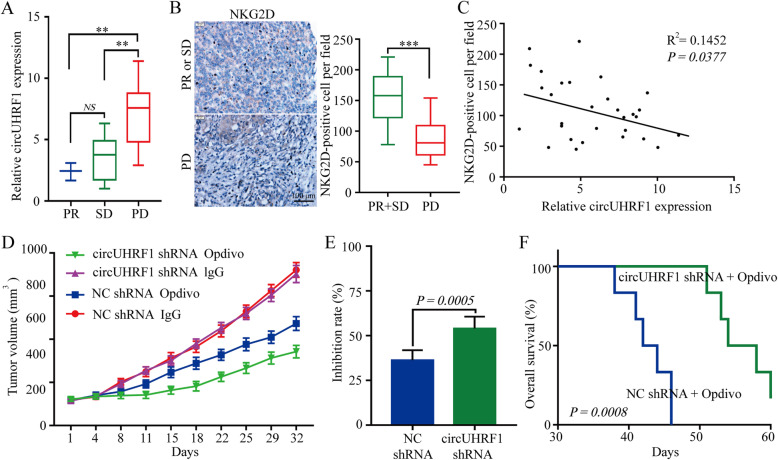
分析了30例进行肝切除术并接受抗PD1免疫治 疗的HCC患者的资料并测定circUHRF1的表达水平,结果表明,PD组的circUHRF1水平明显高于SD组和PR组。此外,检测了30例HCC患者组织中NKG2D的表达水平。结果表明,与抗PD1治 疗敏感的HCC患者相比,抗PD1治 疗耐药的HCC患者中NKG2D的阳性细胞数明显减少。为直接评估circUHRF1对抗PD1治 疗的影响,通过皮下植入circUHRF1基因敲低的HCCLM3细胞或相应的阴性对照细胞来构建小鼠移植瘤模型。结果表明,植入circUHRF1基因敲低细胞的小鼠对抗PD1治 疗敏感,并伴随总生存率的提高。根据上述研究,过表达circUHRF1可以提高HCC对抗PD1治 疗的耐药性,而靶向circUHRF1可能是恢复HCC对抗PD1治 疗敏感性的有效方法。
发表期刊:Molecular Cancer
影响因子:15.302
发表时间:2020.6.29
文章链接:Exosomal circSHKBP1 promotes gastric cancer progression via regulating the miR-582-3p/HUR/VEGF axis and suppressing HSP90 degradation
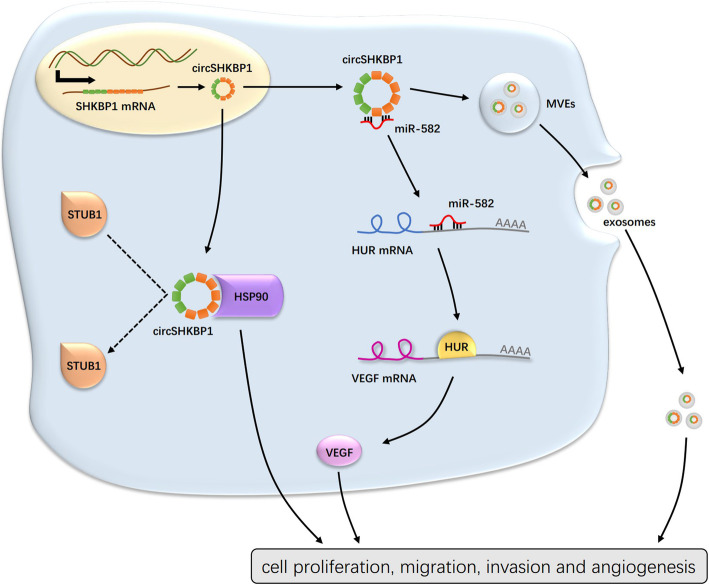
2020年6月29日,“Exosomal circSHKBP1 promotes gastric cancer progression via regulating the miR-582-3p/HUR/VEGF axis and suppressing HSP90 degradation”,文中阐述了circSHKBP1能够在胃ai患者的肿 瘤和血清中高表达,并且可以被外泌体递送,通过海绵吸附miR-582-3p并抑 制HSP90的降解从而起到促ai作用,为胃ai(GC)的发病机理研究提供了新的理论基础。
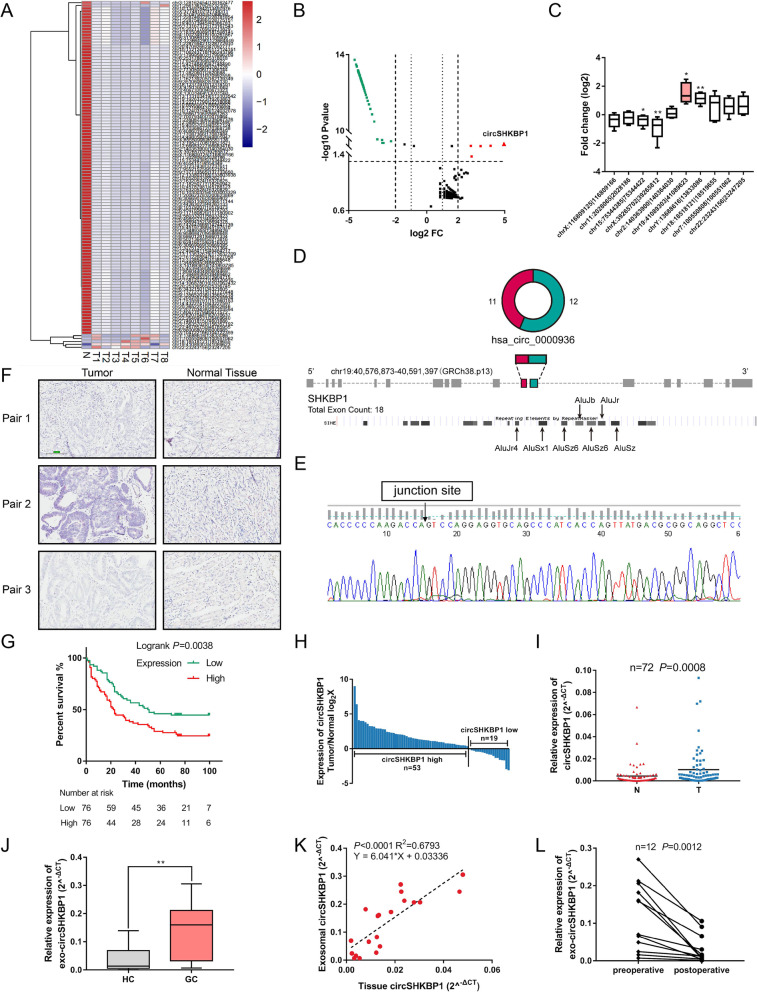
作者首先通过外泌体环状RNA测序在8例GC组织和8例正常组织的样本中 共鉴定出119种差异表达的circRNA。qPCR发现circSHKBP1是GC中差异表达明显的circRNA。设计反式剪切位点引物扩增circSHKBP1并进行Sanger测序和RNase R实验,验证表明circSHKBP1是高度稳定的环状RNA。对来自GC患者的152对ai组织和正常组织进行ISH分析发现GC组织的circSHKBP1丰度远高于正常组织,且circSHKBP1的表达与晚期TNM分期、血管浸润和预后不良相关。
(2)血清外泌体的circSHKBP1来源于GC组织为了确定是否可以在血清外泌体中检测到circSHKBP1,作者收集了20对GC组织和健康组织的血清外泌体,通过电镜(TEM)和WB发现,胃ai患者血清外泌体来源的circSHKBP1比健康对照组更丰富。血清外泌体中circSHKBP1水平约为GC患者肿 瘤组织中circSHKBP1水平的6倍。研究胃切除手术前后血清外泌体的circSHKBP1水平,发现切除肿 瘤后外泌体circSHKBP1水平急剧下降,说明GC组织是外泌体circSHKBP1的来源。以上结果表明,circSHKBP1是一种来源于胃ai组织的circRNA,可以被外泌体有效地输送到循环系统中。此外,circSHKBP1的高表达与晚期TNM分期和GC预后不良相关,使其具有作为GC潜在分子标志物的潜力。
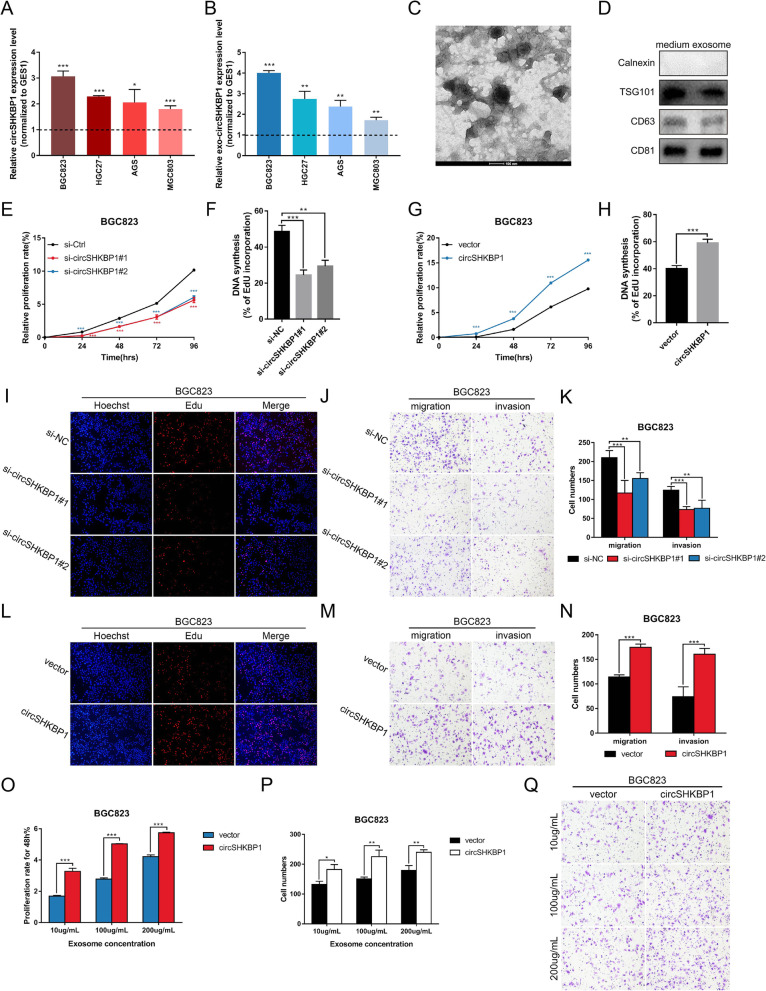
为了探索circSHKBP1是否影响GC细胞的生物学过程,分析了circSHKBP1在4种人GC细胞系(BGC823、HGC27、AGS和MGC803)和正常胃上皮细胞系GES1中的表达水平。结果表明,circSHKBP1在4个GC细胞系中均高表达。此外,来自BGC823细胞培养基的外泌体circSHKBP1在GC细胞系中也存在过表达。随后,以circSHKBP1反向剪接序列的siRNA来敲低circSHKBP1,用pcDNA3.1-CMV-circRNA载体构建circSHKBP1过表达质粒。CCK8和EdU检测和Transwell检测显示,沉默circSHKBP1明显抑 制GC细胞增殖、迁移和侵袭能力而过表达circSHKBP1则相反。此外,作者从转染了circSHKBP1质粒的BGC823和HGC27细胞培养液中提取外泌体,与未处理的GC细胞共培养。结果表明,外泌体circSHKBP1的过表达也影响了GC细胞的增殖、迁移和侵袭。综上所述,过circSHKBP1能促进GC细胞的增殖、迁移和侵袭并且随着circSHKBP1在GC细胞中的表达,更多的circSHKBP1通过外泌体中干扰其他GC细胞的生物学功能。
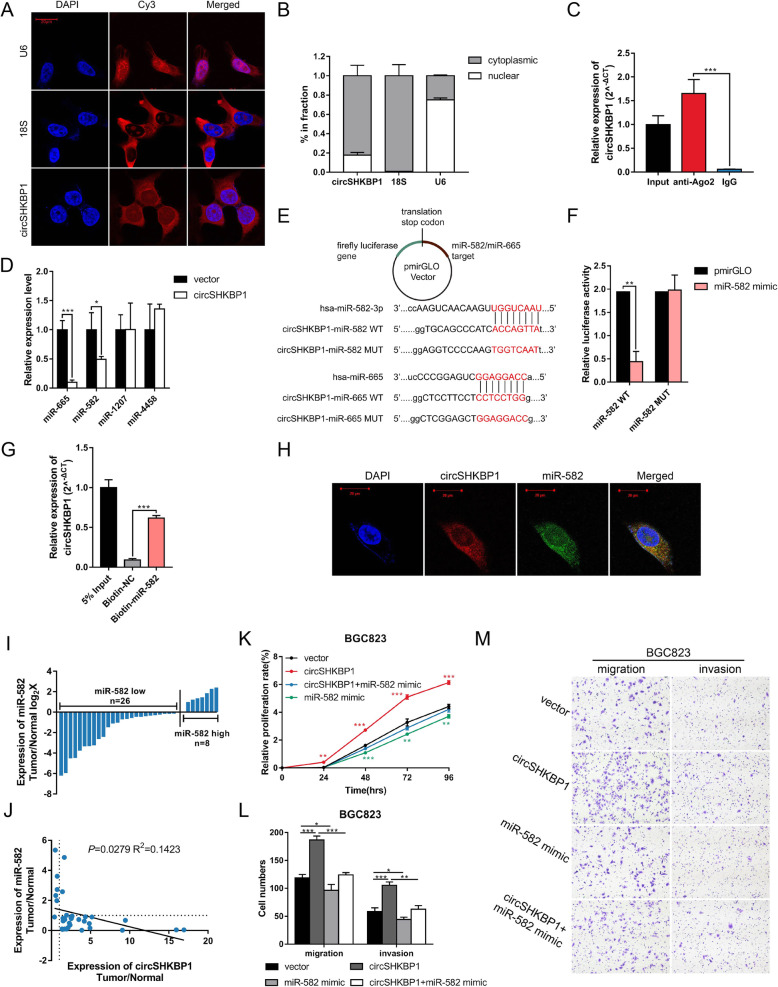
鉴于circRNA海绵吸附miRNA的作用已被广 泛研究,且circSHKBP1在胞质中含量丰富,作者探索了circSHKBP1是否通过作为miRNA的海绵分子来发挥生物学功能。对BGC823细胞中的AGO2进行RIP,结果显示内源性circSHKBP1特异性地富集于AGO2。使用CircInteractome预测可以与circSHKBP1结合的潜在miRNA分子(miR-582-3p、miR-665、miR-1207和miR-4458)。qPCR、RNA pull-down和双荧光素酶报告实验证实只有miR-582-3p可以直接与circSHKBP1互作。综上所述,circSHKBP1可以充当miR-582-3p的海绵分子并降低miR-582-3p的表达。随后作者将miR-582-3p单独转染或与circSHKBP1质粒共转染到GC细胞中。CCK8和Transwell分析表明,miR-582-3p会抑 制GC细胞的增殖、迁移和侵袭,而过表达circSHKBP1则消除了它对GC细胞生长的抑 制作用,这表明circSHKBP1是通过海绵吸附miR-582-3p来发挥的促ai作用。
分析临床数据发现circSHKBP1高表达组的血管浸润率明显较高。使用生信分析网站找到了miR-582-3p的下游靶标HUR和EIF2S1,它们是VEGF(促进内皮细胞增殖)信号通路的一部分。WB分析显示,过表达circSHKBP1会促进HUR和VEGF的表达,而对EIF2S1无影响。此外,miR-582-3p模拟物可以降低BGC823细胞中HUR和VEGF的表达。同样,敲低circSHKBP1下调了HUR和VEGF,随后导入miR-582-3p抑 制剂可以恢复HUR和VEGF的表达水平。HUR的RIP实验证实,它可以与VEGF mRNA和miR-582-3p直接结合。检测GC组织中HUR mRNA的表达水平,发现HUR表达与miR-582-3p表达呈负相关,与circSHKBP1表达呈正相关。结果表明,circSHKBP1可以通过调节HUR来调控VEGF的表达。
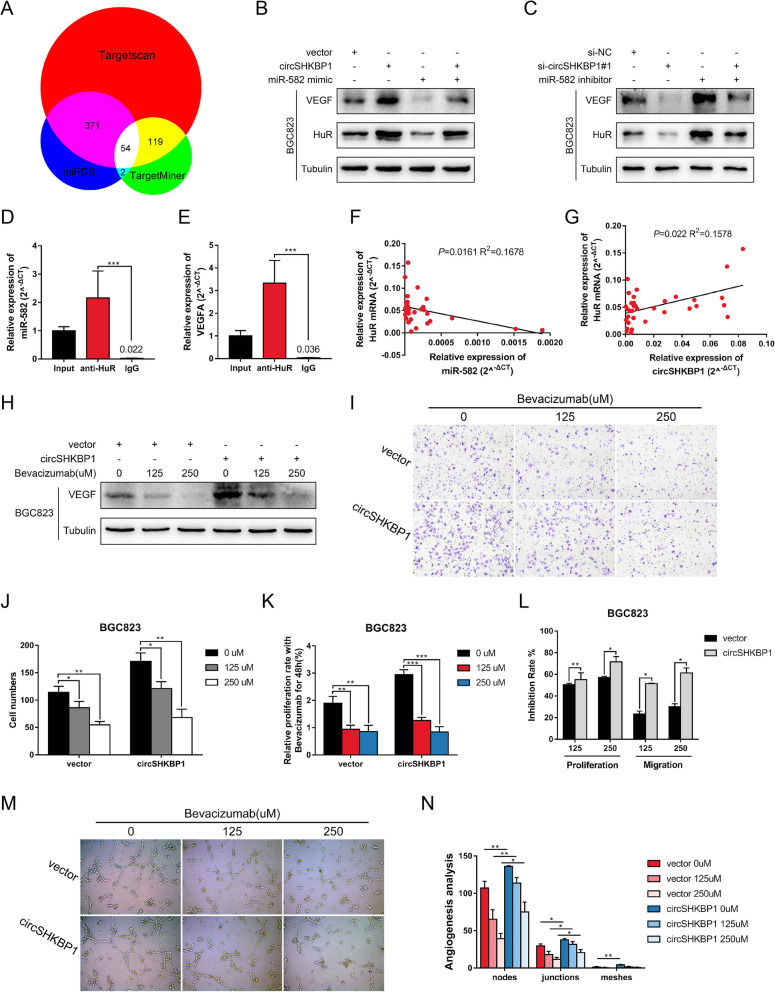
在HGC27细胞中用circSHKBP1探针的RNA pull-down和蛋白质谱结果显示两个差异表达蛋白HSP90β和HSP90α(HSP90的异构体)在过表达circSHKBP1的GC细胞中富集。RIP实验显示,circSHKBP1能直接作用于HSP90。使用qPCR和ELISA分别检测HSP90的mRNA和蛋白水平,结果显示GC肿 瘤组织中的HSP90 mRNA和蛋白均上调且HSP90蛋白表达与circSHKBP1表达呈正相关。然而,在过表达circSHKBP1中使用CHX抑 制蛋白,HSP90的降解受到明显抑 制。由于泛素连接酶STUB1可以泛素化HSP90。使用蛋白酶体抑 制剂MG132处理时HSP90的降解速度减慢。结合上述研究,作者认为circSHKBP1和STUB1竞争性结合HSP90,通过IP分析获得证实。此外,HSP90的抑 制剂NMS-E973在体外削弱了circSHKBP1的促ai作用。这些结果表明,circSHKBP1可以直接与HSP90结合,并抑 制STUB1对HSP90的泛素化,从而促进GC的发展。
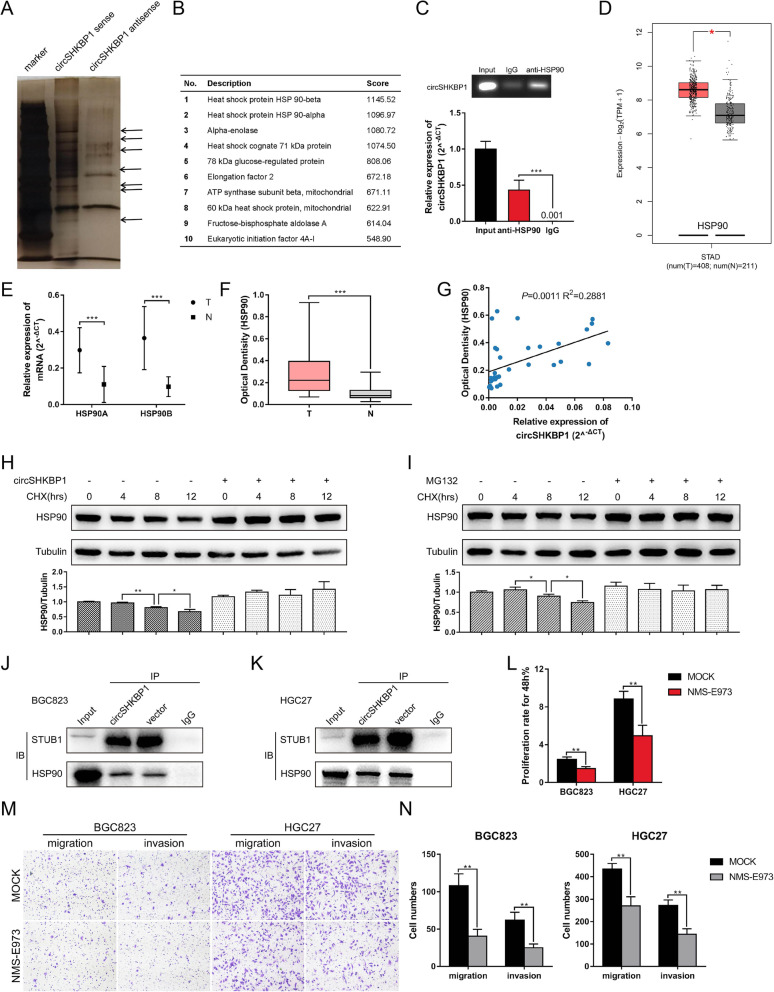
作者构建了circSHKBP1沉默株系(LV3-sh1、LV3-sh2)和超表达株系(LV5-circSHKBP1),将相应细胞接种到小鼠体内,发现源自LV3-sh1细胞的肿 瘤明显小于源自LV3-NC的,表明敲低circSHKBP1会抑 制肿 瘤生长。另外,将转导LV5-circSHKBP1和LV5-NC的细胞接种到裸鼠体内,并对每组中一半数量的小鼠每周给予两次VEGF抗体。发现源自LV5-circSHKBP1细胞的肿 瘤比源自LV5-NC细胞的肿 瘤更大且更重。此外,qPCR 鉴定血清外泌体和肿 瘤的circSHKBP1的表达,发现外泌体circSHKBP1依赖于ai组织circSHKBP1的表达,这证实了circSHKBP1可通过外泌体递送到其他部位,并可在循环系统中检测,这使其可能成为一种很有潜力的GC分子标志物。
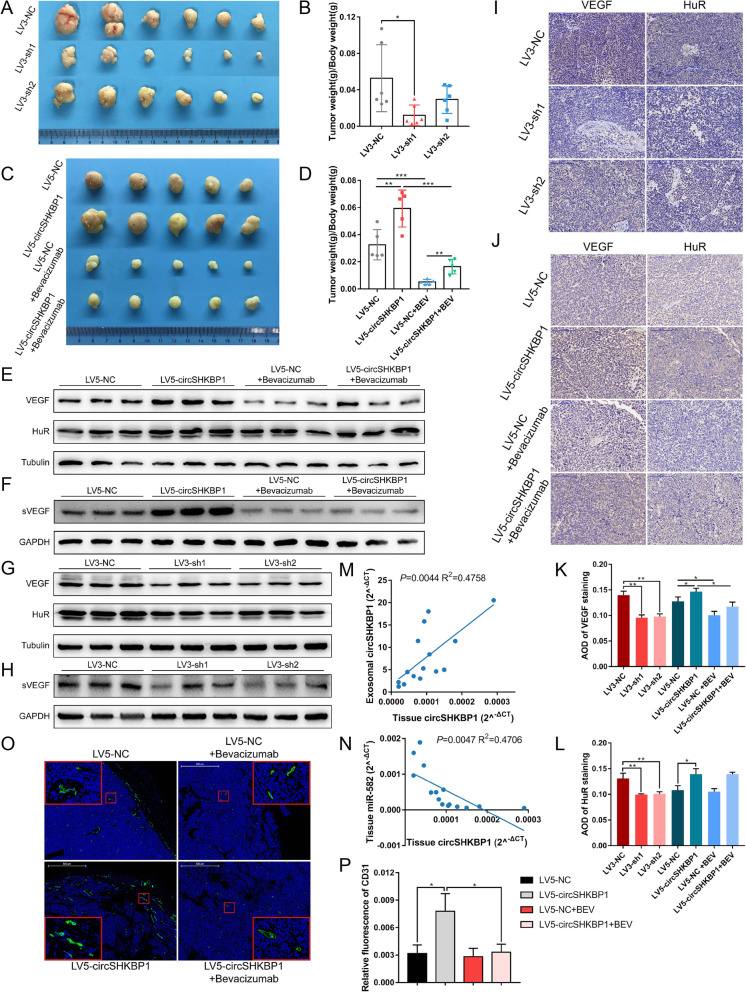
为了探索circSHKBP1对体内胃ai转移的影响,作者将荧光素转染到上述5个细胞系,然后注入裸鼠体内。LV5-circSHKBP1和LV5-NC组中的一半的小鼠每周接受两次VEGF抗体处理。结果表明,敲低circSHKBP1可明显减少肺转移灶的数目和大小且ISH显示,敲低circSHKBP1会导致GC肺转移灶中的HUR和VEGF染色明显减少。而过表达circSHKBP1可以加重肺转移病变和增加HUR和VEGF染色。而VEGF抗体可以抑 制circSHKBP1诱导的ai细胞转移。
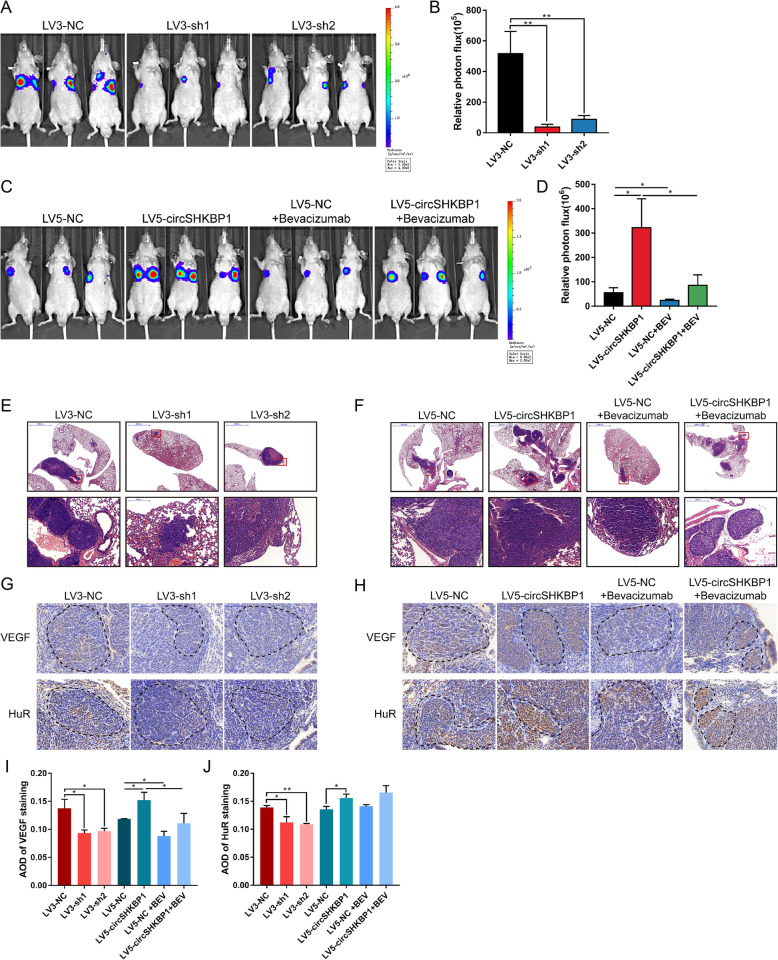
发表期刊:Molecular Cancer
影响因子:15.302
发表时间:2020.7.27
文章链接:Exosomal circPACRGL promotes progression of colorectal cancer via the miR-142-3p/miR-506-3p- TGF-β1 axis
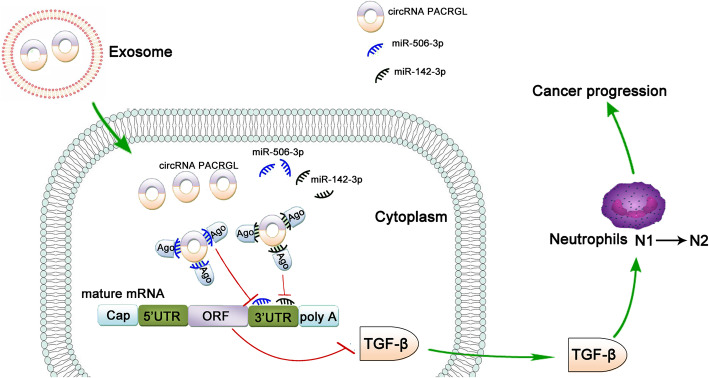
2020年7月27日,发表于Molecular Cancer(IF=15.302)的“Exosomal circPACRGL promotes progression of colorectal cancer via the miR-142-3p/miR-506-3p- TGF-β1 axis”首 次揭示了来源于肿 瘤细胞外泌体的circPACRGL在大肠ai增殖和转移中的作用机制,为深入研究circRNA在大肠ai治 疗中的作用机制提供了新的理论依据。
为了探索外泌体在CRC中的作用机制,作者首先从CRC细胞系HCT116和SW480的上清液中分离出ai细胞衍生的外泌体。CCK8、伤口愈合实验和Transwell assay显示,过表达外泌体明显增强了CRC细胞的增殖、迁移和侵袭。流式细胞仪分析显示,在过表达外泌体的CRC细胞中,凋亡细胞数目明显低于对照细胞,WB结果显示,CRC衍生的外泌体增加了ai细胞相关的蛋白水平。此外,测试了CRC衍生的外泌体在体内转移瘤模型中的作用,作者发现外泌体处理显明显加了HCT116细胞的转移。综上所述,CRC衍生的外泌体可促进CRC增殖、迁移和侵袭。
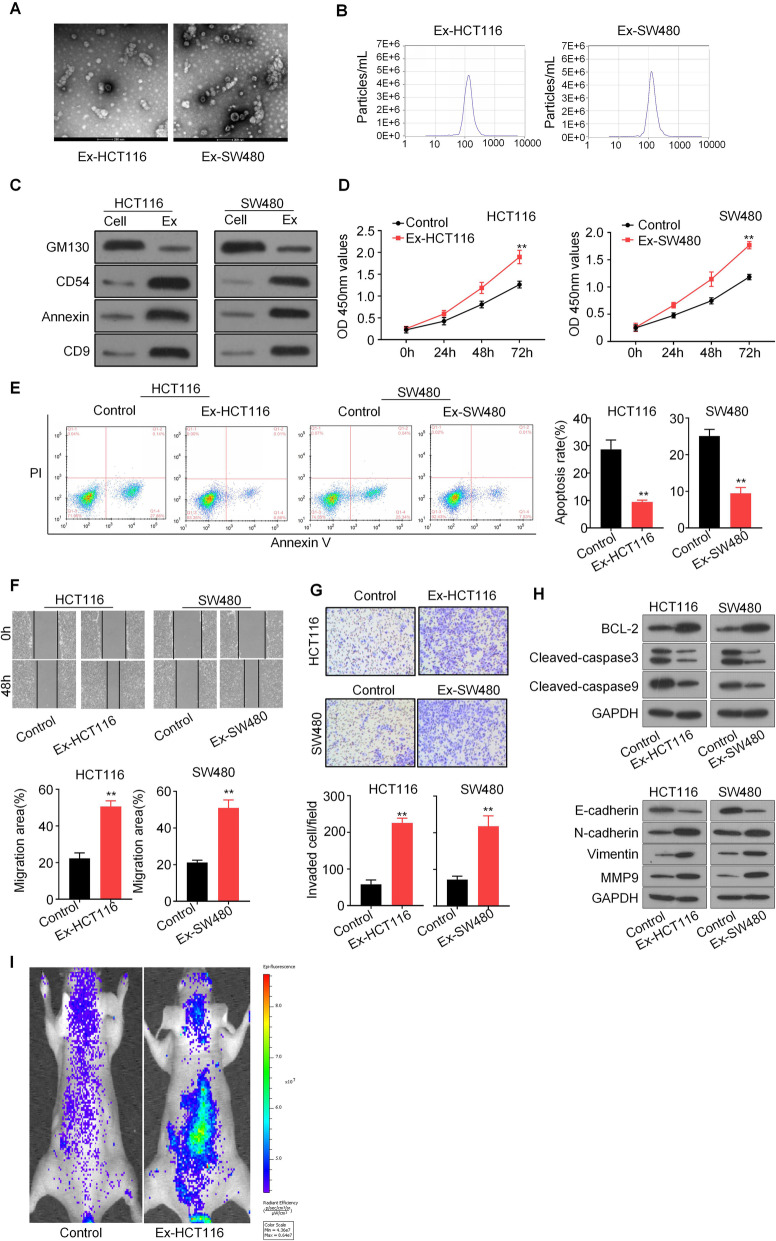
通过外泌体环状RNA测序分析了HCT116和SW480细胞外泌体(Ex-HCT116和Ex-SW480)的表达谱。Venn显示circPAGAL(也称为has_circ_0069313)是两个Ex组中上调明显的基因,并通过qPCR证实。qPCR显示在肿 瘤来源的外泌体刺激下,CRC细胞中circPACRGL的表达明显上调,且circPACRGL可能来源于肿 瘤衍生的外泌体。为了研究circPACRGL是否为CRC进展所必需的,作者进行了功能缺失分析,将circPACRGL-siRNA转染到HCT116和SW480细胞中敲低circPACRGL后,使用肿 瘤来源的外泌体刺激两种CRC细胞,显示circPACRGL mRNA表达明显增加。这些结果表明,circPACRGL主要来自肿 瘤来源的外泌体。
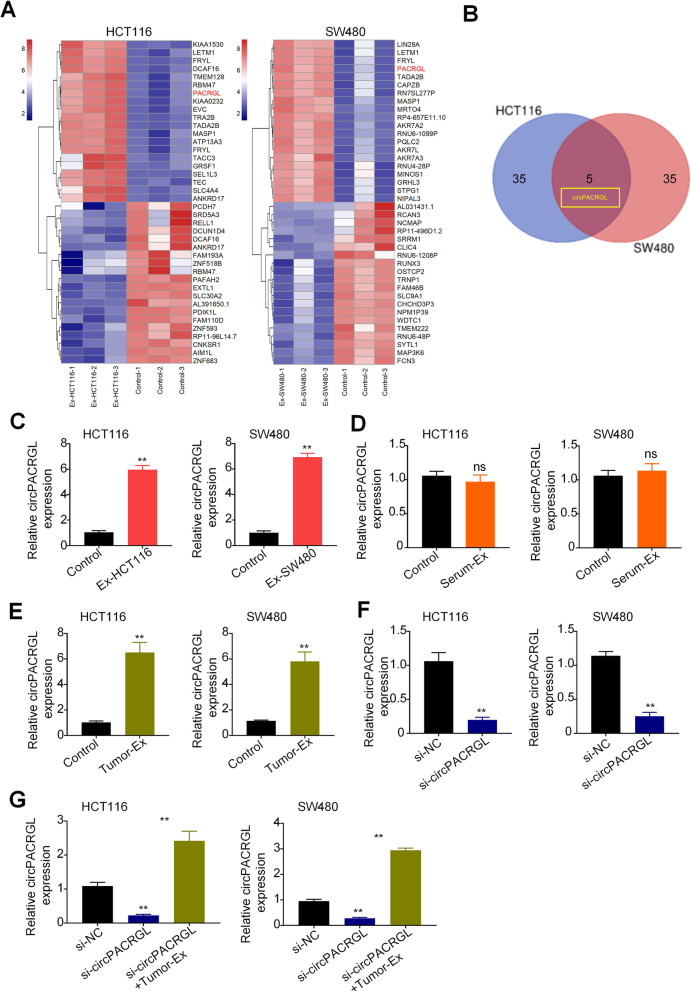
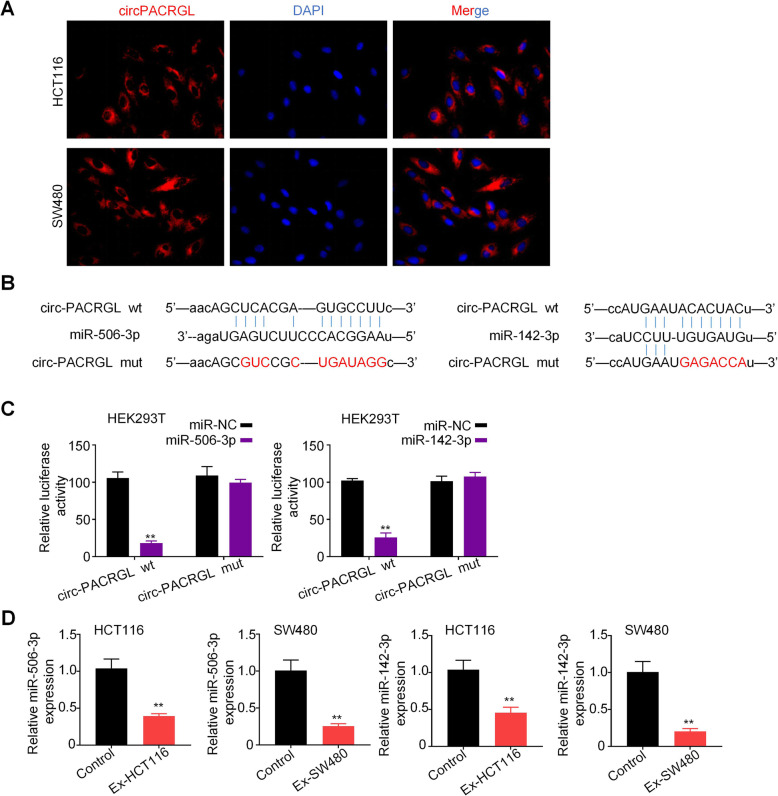
作者使用生物信息学数据库预测发现circPACRGL同时具有miR-142-3p和miR-506-3p的结合位点,双荧光素酶报告实验检测也证实miR-142-3p和miR-506-3p可与circPACRGL直接结合。此外,在CRC细胞来源的外泌体刺激的HCT116和SW480细胞中,miR-142-3p和miR-506-3p表达均明显降低。这些结果表明,circPACRGL可以海绵吸附miR-142-3p和miR-506-3p,并抑 制二者的表达。
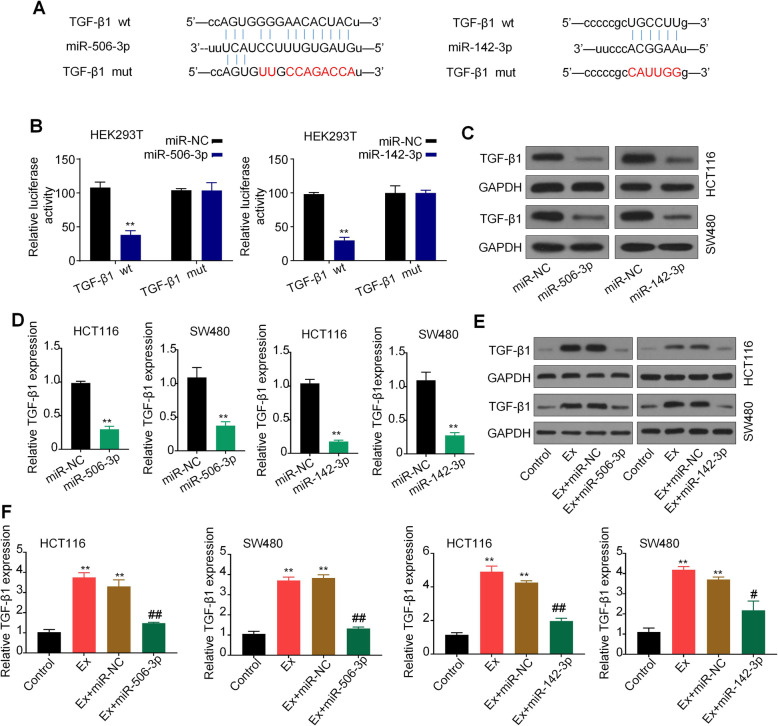
使用生物信息学预测了miR-142-3p和miR-506-3p的下游靶基因TGF-β1。通过双荧光素酶报告实验,证实了TGF-β1是miR-142-3p和miR-506-3p的共同靶基因。qPCR和WB分析进一步表明,转染miR-142-3p/miR-506-3p可明显降低TGF-β1的mRNA和蛋白水平。为了进一步证实miR-142-3p和miR-506-3p对TGF-β1的调节作用,作者使用miR-142-3p/miR-506-3p 处理CRC衍生的外泌体刺激的CRC细胞,结果显示导入CRC衍生的外泌体后,CRC细胞中TGF-β1的mRNA和蛋白水平均明显增加,而与miR-142-3p/miR-506-3p共同处理后,TGF-β1表达的促进作用被有效抑 制。综上所述,TGF-β1是miR-142-3p和miR-506-3p的共同靶标。
根据以上数据,作者推测circPACRGL可能通过miR-142-3p /miR-506-3p-TGF-β1轴来调控CRC细胞增殖、迁移和侵袭。CCK8结果显示,在CRC衍生的外泌体治 疗组(Ex-HCT116)中,CRC细胞增殖明显高于对照组。敲低circPACRGL明显降低了CRC细胞增殖,而miR-142-3p/miR-506-3p抑 制剂处理或过表达TGF-β1后,这种抑 制作用会相应减弱。在细胞凋亡实验中也观察到了类似的效果。接下来,划痕实验和Transwell分析均显示CRC衍生的外泌体可以增强CRC细胞的迁移和侵袭能力,而在circPACRGL敲低的细胞中则发生了相反的作用,CRC衍生的外泌体处理可以回补circPACRGL敲低细胞的迁移和侵袭能力。与CCK8和细胞凋亡检测结果一致,miR-142-3p / miR-506-3p抑 制剂处理或过表达TGF-β1明显促进了circPACRGL敲低细胞的迁移和侵袭能力。以上结果表明,circPACRGL通过调节miR-142-3p /miR-506-3p-TGF-β1过程促进CRC细胞增殖、迁移和侵袭。
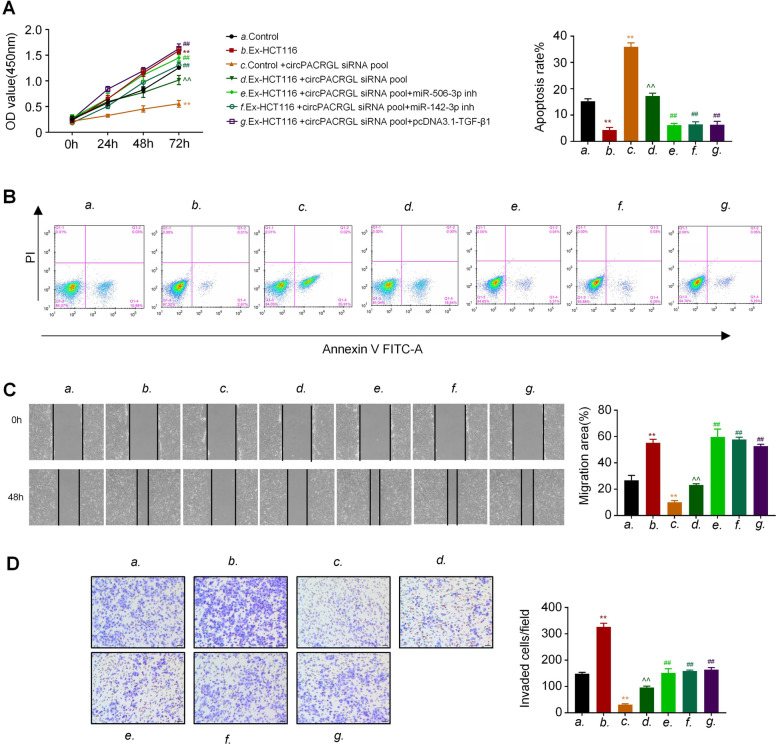
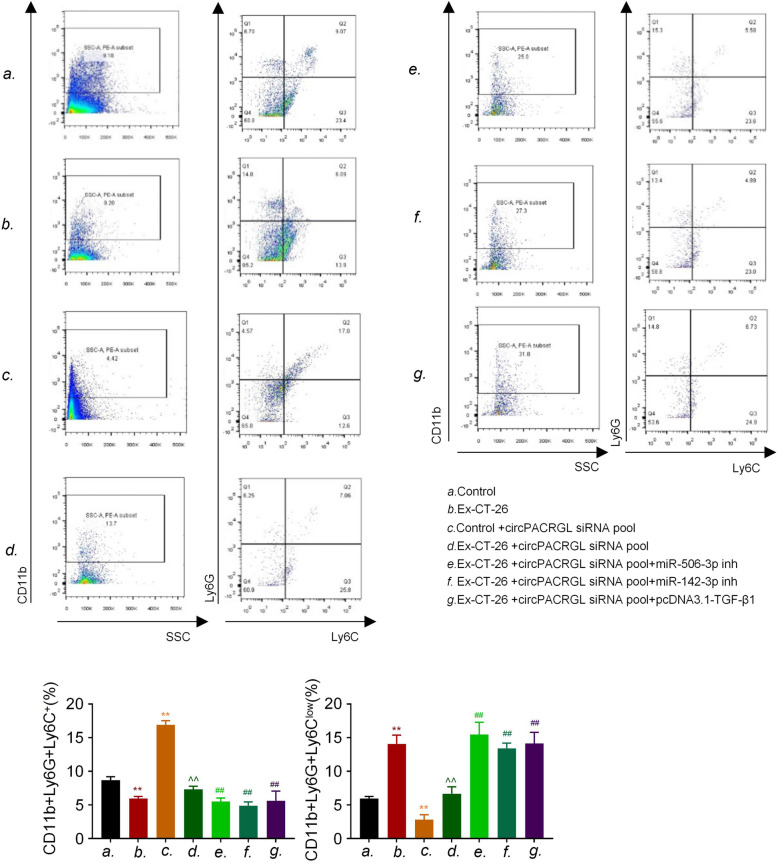
上述研究表明,circPACRGL通过miR-142-3p/miR-506-3p-TGF-β1过程促进大肠ai的发展。作者进一步探讨CRC衍生的外泌体circPACRGL是否也可以通过这个轴调节中性粒细胞的N1-N2分化。流式细胞仪检测结果显示,CRC衍生的外泌体可以增加N2中性粒细胞的百分比,这与N2标记物CD11b + / Ly6G + / Ly6Clow的上调相一致。相比之下,在circPACRGL敲低的细胞中,N2中性粒细胞的百分比明显降低,而加入CRC衍生的外泌体后,这种抑 制作用被取消。此外,miR-142-3p/miR-506-3p抑 制剂处理或过表达TGF-β1可以明显增加circPACRGL敲低细胞中N1-N2的分化。综上分析,CRC衍生外泌体的circPACRGL通过miR-142-3p /miR-506-3p-TGF-β1过程促进N1-N2中性粒细胞的分化。
总体来说,上述三篇研究通过外泌体提取、外泌体鉴定、外泌体环状RNA测序、qRT-PCR、Sanger测序、RNA pull-down+MS/WB、RIP以及双荧光素酶报告实验等方法(云序可提供以上服务),探究外泌体环状RNA通过海绵机制吸附miRNA进而调控下游疾病相关基因mRNA的表达过程,影响ai症发展进程。这为研究和理解生物体复杂的外泌体环状RNA调控机制,提供了比较完整的实验研究思路和方案,具有很强的理论先导性和示范性,也为疾病的调控和靶点提供了重要的理论依据。
云序外泌体环状RNA课题技术服务四大模块
01 外泌体的提取与鉴定
1.1 电镜
提取血清血浆或细胞上清中的外泌体后进行电镜观察。
1.2 NTA
检测外泌体粒径大小。
1.3 WB
验证外泌体标志蛋白CD9和TSG101等经典外泌体标志物蛋白。
02 外泌体样品测序服务
2.1外泌体全转录组测序
同时检测外泌体样品中mRNA、lncRNA和circRNA,获得全 面的转录组信息。
2.2外泌体环状RNA测序
充分去除外泌体样品中的线性RNA,特异性地检测环状RNA
2.3 外泌体LncRNA测序
云序生物提供的LncRNA测序同时检测外泌体样品中的LncRNA和mRNA。
2.4 外泌体mRNA测序
检测外泌体中的mRNA表达情况。
2.5外泌体miRNA测序
测序外泌体中的miRNA表达情况。
03筛选验证
3.1qRT-PCR
对选定目标RNA分子可进行qPCR检测服务,包括引物设计与表达鉴定。
3.2Sanger测序与RNase R酶耐受实验
对选定的环状RNA分子进行反式剪切位点引物设计,扩增后Sanger测序验证环状;使用
