云序客户四川大学华西口腔刘钧教授课题组在Stem Cell Reviews and Reports 杂志上发表了题为“METTL3-Mediated lncRNA m6A Modification in the Osteogenic Differentiation of Human Adipose-Derived Stem Cells Induced by NEL-Like 1 Protein”的研究论文。本研究首次发现了METTL3可通过调控lncRNA的m6A修饰和表达来激活MAPK信号通路,从而促进人体脂肪干细胞(hASCs)的成骨分化。云序生物有幸参与了此项研究中的m6A MeRIP-seq、RNA-seq等高通量技术服务,用成熟、精准的测序技术助力科学研究。

发表期刊:Stem Cell Reviews and Reports
影响因子:6.692
发表时间:2021年9月10日
研究方法:m6A MeRIP-seq、RNA-seq、MeRIP-qPCR、RIP-qPCR
文章链接:METTL3-Mediated lncRNA m6A Modification in the Osteogenic Differentiation of Human Adipose-Derived Stem Cells Induced by NEL-Like 1 Protein
云序生物提供的服务

1. lncRNA m6A在dhASCs和NELL1-dhASCs中的修饰特征
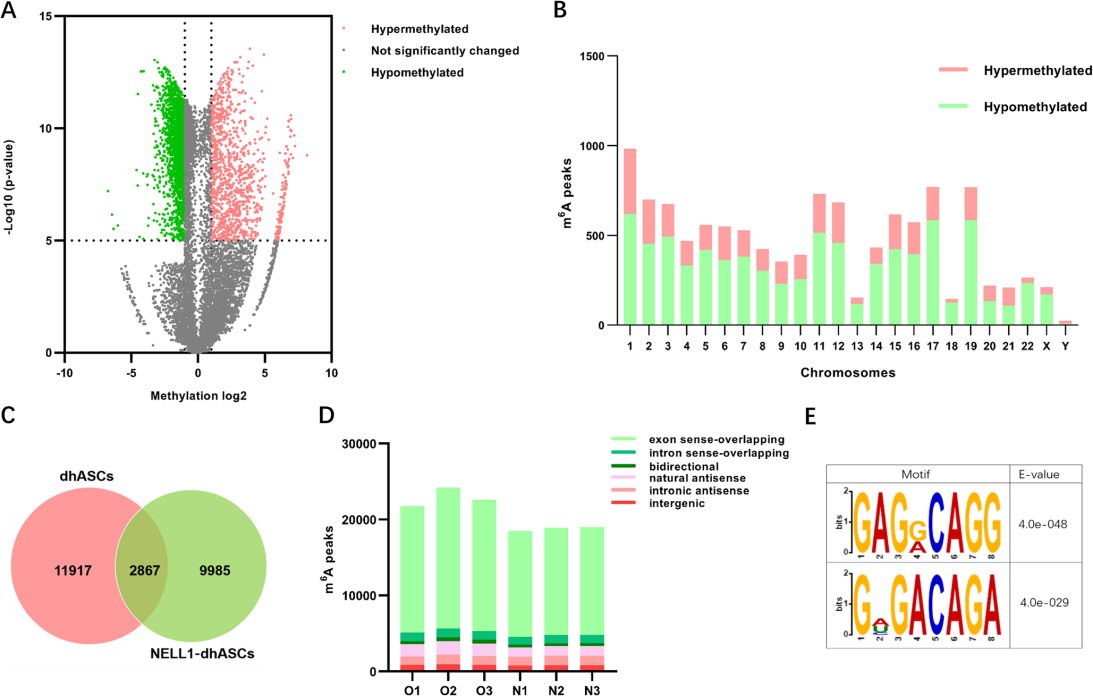
为了探索lncRNA m6A在人类脂肪干细胞成骨分化过程中的修饰特征,作者首先对dhASCs和NELL1-dhASCs两种干细胞样品进行了m6A MeRIP-seq和RNA-seq。根据lncRNAs与邻近编码基因转录物的关系,m6A峰主要分为6种类型:双向、外显子同义重叠、内含子同义重叠、内含子反义、自然反义和基因间。对m6A MeRIP-seq结果进行数据分析,发现外显子同义重叠类型的m6A峰最为丰富。其次,对dhASCs和NELL1-dhASCs的m6A峰进行比较,共发现两者的m6A峰有2867个重叠,共有11462个差异甲基化峰,其中3379个差异高甲基化峰和8082个低甲基化峰(图1a)。此外,差异甲基化的m6A峰主要位于1号染色体上(图1b)。
这些结果证实了在hASCs的成骨分化过程中确实存在大量的lncRNA m6A修饰,并且在dhASC和NELL1-dhASC组中也存在许多差异甲基化峰,这表明lncRNA m6A修饰也可能参与调控了NELL-1蛋白诱导的成骨分化过程。
2. METTL3促进体外NELL-1蛋白诱导的hASCs成骨
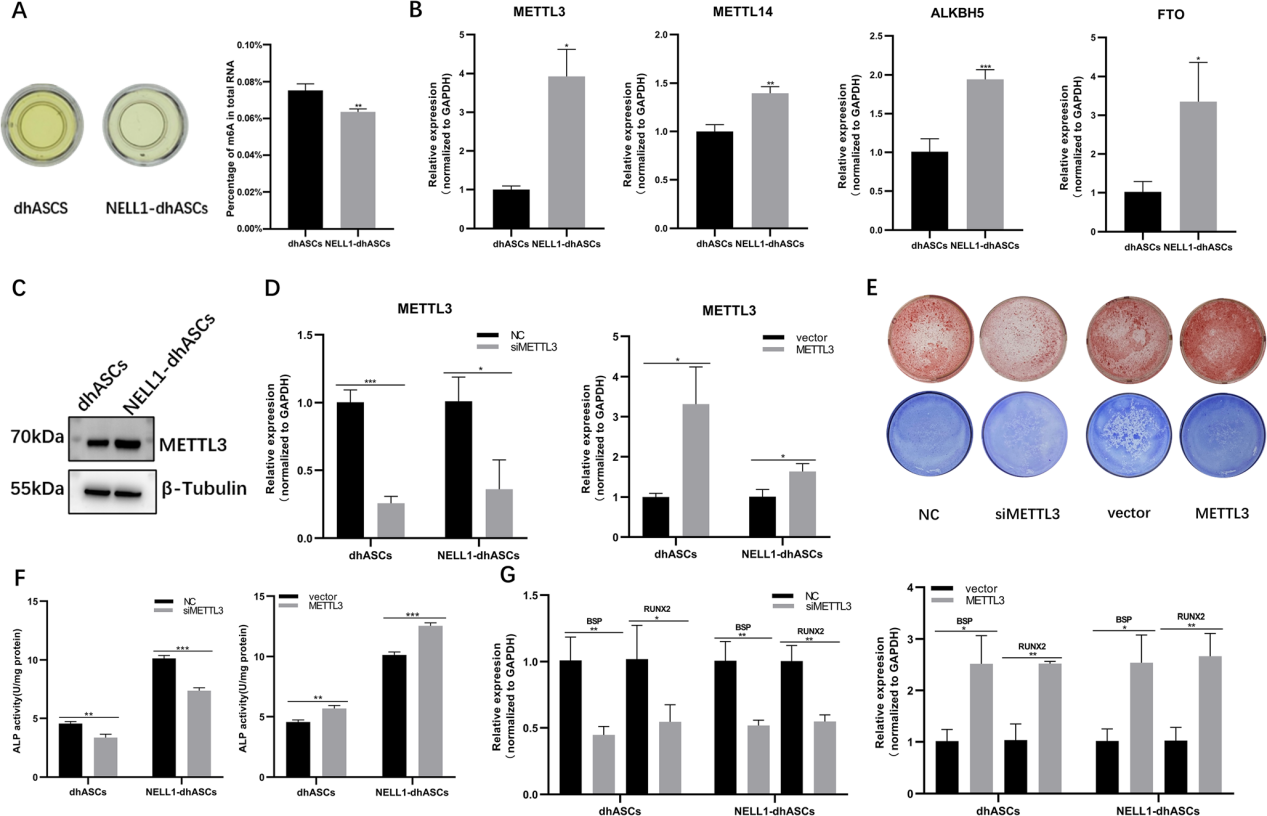
通过m6A MeRIP-seq检测,发现dhASCs中RNA的总m6A修饰水平高于NELL1-dhASCs,表明m6A修饰水平可能随着成骨的增加而降低(图2a)。同时检测了几种m6A相关酶的表达,发现METTL3在NELL1- dhASCs中的表达水平高于dhASCs(图2b),METTL3的蛋白含量也在NELL1-dhASCs中较高(图2c)。为了更好地验证METTL3在NELL-1诱导的hASCs成骨分化中的作用,作者在NELL-1蛋白诱导的人脂肪干细胞中进行了METTL3过表达和敲除的体外功能实验。通过qRT-PCR检测结果证实了过表达和敲除的效率(图2)。NELL1-dhASCs的ARS染色和ALP染色均显示METTL3敲除后矿化减少(图2e)。同样,在dhASCs和NELL1-dhASCs中,ALP活性降低(图2f)。此外,成骨基因RUNX2和BSP的表达水平也降低(图2g)。
这些结果表明,METTL3基因敲除导致dhASCs和NELL1-dhASCs的成骨分化减弱。此外,为了更好地验证METTL3的成骨调控作用,我们过表达了METTL3,得到了相反的结果。通过体外实验,证明了METTL3在NELL-1诱导的hASCs成骨分化中是一个重要的调节因子,具有促进作用。
3. LncRNARP11-44 N12.5促进体外hASCs成骨
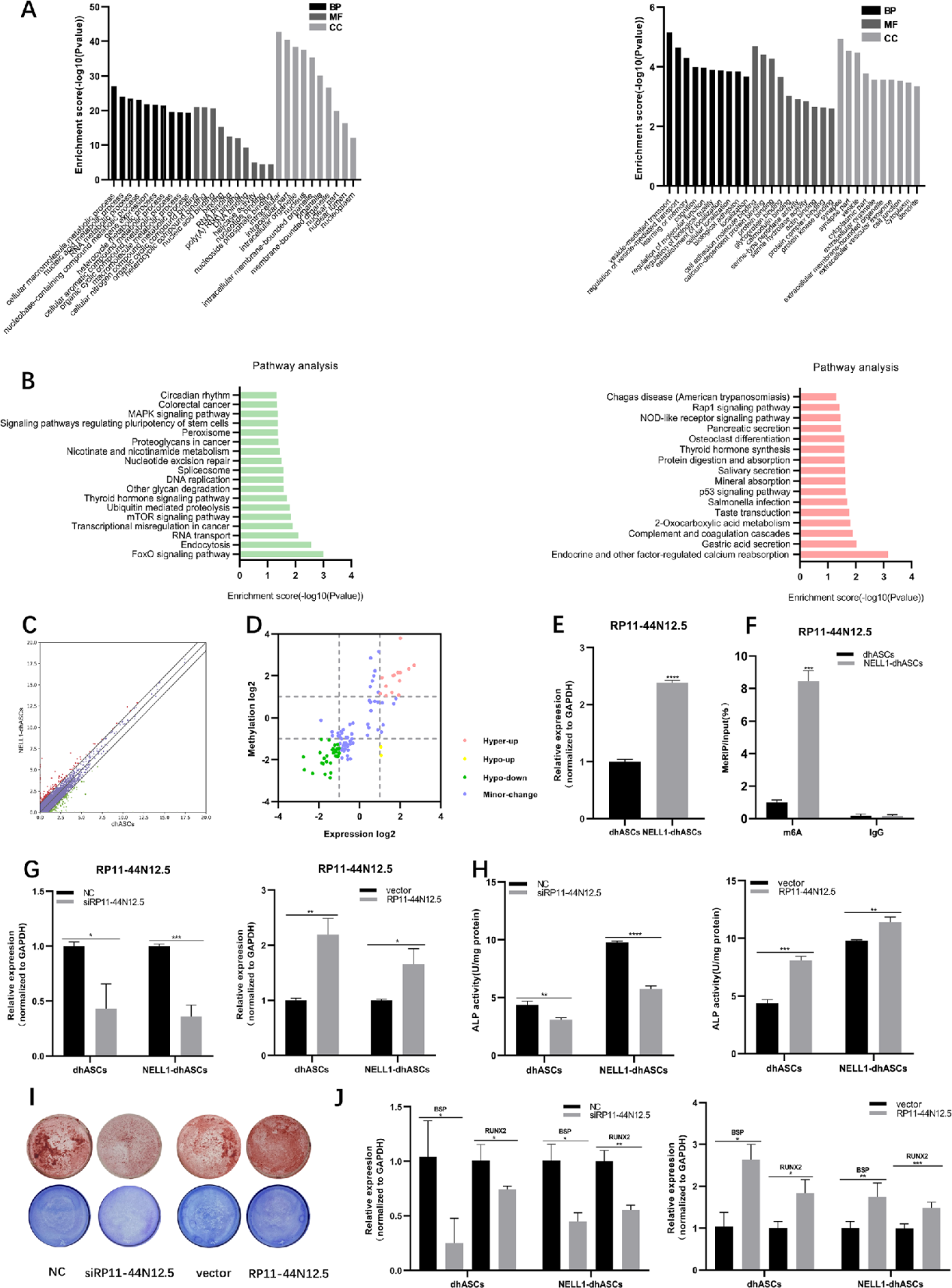
为了进一步了解差异甲基化的LncRNA在功能调控中的作用,作者根据LncRNA的邻近位置,对其预测靶 mRNA进行了GO富集分析和KEGG通路分析。在dhASCs和NELL1-dhASCs中,差异高甲基化LncRNAs附近的基因富集了641个GO功能,而低甲基化lncRNAs附近的基因富集了663个GO功能。通过KEGG通路分析,发现差异甲基化的lncRNA共富集了34条通路,其中高甲基化的lncRNA参与了16条通路,低甲基化的lncRNA只参与了18条通路(图3b)。其中有三条富集通路与成骨密切相关:p53信号通路、MAPK信号通路和FOXO信号通路。在dhASC和NELL1-dhASC中,RNA-seq结果显示存在616个差异表达的lncRNA,其中包括386个上调的lncRNA和230个下调的lncRNA(图3c)。
为了更好地了解m6 A甲基化与表达之间的关系,他们将差异表达的lncRNA和差异甲基化的lncRNA结合起来进行了联合分析。为进一步探讨m6A修饰的lncRNA在hASCs成骨分化中的作用和调控,根据KEGG分析选择了MAPK信号通路中富集的低甲基化上调lncRNA RP11- 44 N12.5。通过qRT-PCR和MeRIP-qPCR发现其表达水平和m6A修饰水平在dhASCs和NELL1-dhASCs中上调(图3e和f),结果与RNA-seq和m6A MeRIP-seq结果一致,从而证实了其可靠性。
作者通过qRT-PCR验证了RP11-44 N12.5在dhASCs和NELL1-dhASCs中的转染效率(图3g)。体外实验进一步验证了RP11-44 N12.5调控hASC成骨的能力。敲除RP11-44 N12.5后,ARS和ALP染色显示矿化结节减少(图3i),与对照组相比,敲除组ALP活性降低(图3h)。BSP和RUNX2的表达水平也降低(图3j)。然而,当RP11-44 N12.5过表达时,表型变化被逆转。矿化结节(图3i)、ALP活性(图3h)和成骨基因表达水平(图3k)升高。提示RP11-44 N12.5是促进hASCs成骨分化的重要调控因子。
METTL3已被证明作为一种m6A甲基转移酶参与多种生理过程的调节。因此,他们推测METTL3可能靶向并调控RP11-44 N12.5的m6A修饰。首先,METTL3被敲除后,发现RNA的总m6A修饰水平降低,这表明METTL3可以调节hASCs成骨分化过程中的m6A修饰(图4a)。敲除METTL3后,发现RP11-44 N12.5的m6 A修饰水平降低,表达水平也降低,表明METTL3不仅调控RP11-44 N12.5的m6A修饰,而且对其表达也有影响(图4b和c)。此外,通过RIP-qPCR证实了METTL3与RP11-44 N12.5的结合(图4d)。利用IGV软件对RP11-44 N12.5的m6A峰进行可视化,并预测了METTL3与RP11-44 N12.5的结合位点(图4e)。过表达RP11-44 N12.5逆转了METTL3敲除后的表型,进一步证实了METTL3的调控作用(图4f、g和h)。
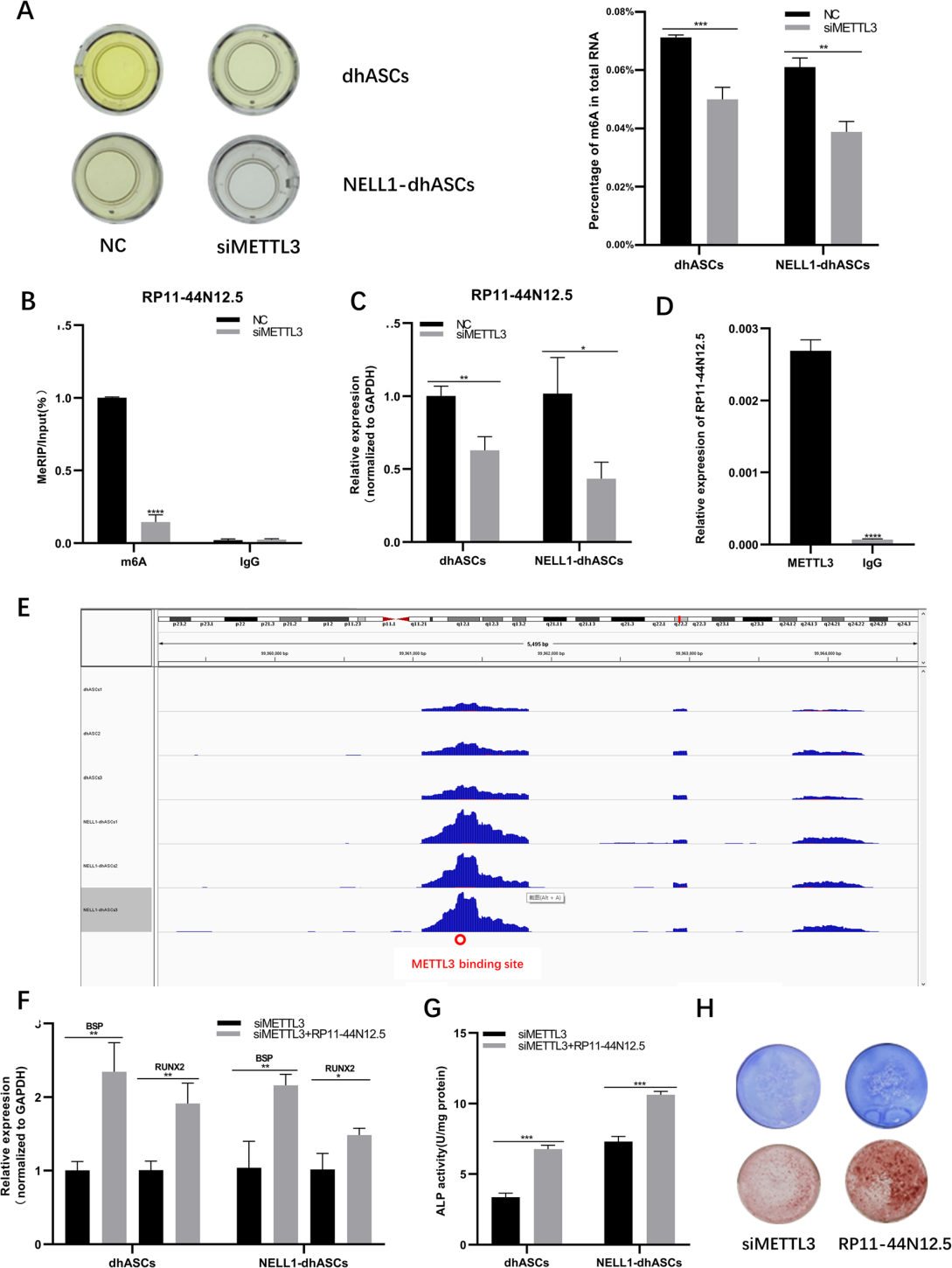
5. METTL3/RP11-44 N12.5/STK3轴调控MAPK信号通路
首先通过生物信息学分析,预测出RP11-44 N12.5在MAPK信号通路中富集,靶基因为生发中心激酶II (GCK II)家族成员STK3。因此,他们推测METTL3可能通过调控RP11-44 N12.5的m6A修饰影响STK3的表达,从而影响MAPK信号通路,最终调控hASCs的成骨分化。首先,敲除RP11-44 N12.5后发现STK3的表达降低,但过表达RP11-44 N12.5后结果相反,这一结果证明了RP11-44 N12.5可以调节STK3的表达(图5)。同样,敲除RP11-44 N12.5也导致了MAPK信号通路中三个关键蛋白(ERK、JNK和p38)的磷酸化降低,过表达RP11-44 N12.5导致这三个关键蛋白(ERK、JNK和p38)的磷酸化增加(图5)。这表明RP11- 44 N12.5通过调控STK3而激活MAPK信号通路。通过western blot实验,发现在敲除METTL3后,STK3的表达也降低(图5c)。METTL3敲除也导致三个关键蛋白(ERK、JNK和p38)的磷酸化水平降低(图5f)。
以上结果证实了METTL3/RP11-44 N12.5/STK3轴的存在,该轴可以调节MAPK信号通路,影响hASCs的成骨分化。此外,研究结果首次揭示了METTL3在hASCs成骨分化过程中的调控机制。

本文中首先通过MeRIP-seq、RNA-seq联合分析,找出了NELL1-dhASCs中的差异m6A修饰lncRNA。然后进一步进行KEGG分析,发现了MAPK信号通路中富集的其他lncRNA,筛选出目标lncRNA RP11-44 N12.5,并预测出其潜在靶基因为STK3。通过检测过表达和敲除RP11-44 N12.5后STK3的表达水平,证实了RP11-44 N12.5对STK3的靶向作用。进一步研究发现,METTL3能够通过诱导RP11-44 N12.5的m6A修饰及其表达影响STK3,导致p38/JNK/ ERK磷酸化水平和表达水平升高,激活MAPK信号通路。
综上所述,本研究证实METTL3可以影响rp11-44 N12.5与STK3的结合,从而激活MAPK信号通路,最终影响hASCs的成骨分化。这些发现为骨组织工程提供了新的思路。该文章为从甲基化修饰酶出发的m6A机制研究提供了一个极佳的参考范本。文中机制研究涉及到的整体甲基化水平检测,RNA修饰相关酶筛选,RNA-seq&m6A MeRIP-seq,以及后续MeRIP-qPCR验证,RIP-qPCR机制互作研究等,云序生物均可为您提供一站式服务。
m6A RNA修饰测序(m6A-meRIP-seq)
对m6A RNA甲基化,目前最流行的检测手段为m6A-MeRIP-Seq技术,适用于m6A RNA甲基化谱研究,快速筛选m6A RNA甲基化靶基因。云序可提供mRNA和多种非编码RNA的m6A测序:
- m6A 全转录组测序(涵盖mRNA,LncRNA,circRNA)
- m6A LncRNA测序(涵盖LncRNA和mRNA)
- m6A Pri-miRNA测序(涵盖Pri-miRNA和mRNA)
- m6A mRNA测序
- m6A miRNA测序
LC-MS/MS检测整体RNA修饰水平
精准高效,可以实现一次检测,9类修饰水平检测,一步到位。
比色法检测整体RNA修饰水平
快速检测m6A整体甲基化水平
03 m6A RNA修饰上游酶的筛选
m6A RNA修饰相关酶PCR芯片
寻找上游直接调控m6A RNA甲基化的甲基转移酶。
04 m6A RNA修饰靶基因验证
MeRIP-qPCR/GenSeq® MeRIP试剂盒
云序提供各类不同修饰的meRIP-qPCR服务以及销售GenSeq® MeRIP试剂盒,可针对mRNA,lncRNA,环状RNA等不同类型的RNA分子进行检测,低通量验证RNA修饰靶基因表达水平。05 机制互作研究
5.1 RIP-seq/qPCR/GenSeq® RIP试剂盒
筛选或验证RNA修饰直接靶点,研究RNA修饰靶基因的调控机制。
5.2 RNA pull down -MS/WB
筛选或验证目标RNA互作基因或蛋白,研究相应的分子调控机制。
筛选或验证目标蛋白与DNA互作,研究相应的分子调控机制。
优势二:累计完成数千例 RNA甲基化测序样本,全面覆盖医口、农口等各类样本。
优势三:全面检测mRNA和各类非编码RNA(circRNA,lncRNA,Pri-miRNA等)。
优势四:独家提供多种修饰一站式服务:m6A整体水平检测、m6A测序、MeRIP-qPCR验证、RIP和RNA pull-down等。
优势五:率先研发超微量MeRIP测序技术,RNA量低至500ng起。
优势六:国内最全的RNA修饰测序平台,提供m6A、m5C、m1A、m7G、m3C、O8G、ac4C乙酰化和2'-O-甲基化测序。
相关产品
地 址: 上海市松江区莘砖公路518号24号楼4楼 联系人: 戴小姐 电 话: 021-64878766 传 真: 021-64878766 Email:market@cloud-seq.com.cn;liuqingqing@cloud-seq.com.cn
收藏这篇够了!GEO停用,国产数据库GSA上传全指南
(暂无发布时间 浏览数:3905)
杨宝峰院士团队RNA修饰又一成果 | 云序ac4C acRIP-seq助力揭示心脏I/R损伤的作用机制
(2024-12-03T00:00 浏览数:31197)
杨宝峰院士团队最新成果 | 云序助力揭示RNA修饰m7G调控心肌肥厚的机制研究
(2024-11-13T00:00 浏览数:30196)
Nature子刊| 重磅综述!一文总结「m6A修饰非编码RNAs」在各类肿瘤中的调控机制及作用
(暂无发布时间 浏览数:21060)
研究速览-eccDNA 2023年最新进展大放送!
(暂无发布时间 浏览数:26898)
云序生物MeRIP-qPCR技术干货
(暂无发布时间 浏览数:26479)
技术干货| “eccDNA碱基序列的获取及引物设计”方法教程
(暂无发布时间 浏览数:22517)
云序客户m6A高分文章|揭示组蛋白乙酰化与m6A修饰在眼部黑色素瘤发生中的共同作用机制
(暂无发布时间 浏览数:13947)
Nat Biotechnol IF=47 | BID-seq:一种基于单碱基分辨率的假尿嘧啶(Ψ)修饰定量测序检测方法
(暂无发布时间 浏览数:14013)
北大伊成器团队Nature Reviews重磅发文:非m6A热门修饰调控与功能一文速览!
(暂无发布时间 浏览数:19370)
上海云序生物科技有限公司
商家主页
相关咨询
